Description
Le « Plantar test » ou « Hargreaves » (méthode décrite par K.Hargreaves) mesure automatiquement le seuil nociceptif d’un rongeur dont la voute plantaire est soumise à un stimulus thermique infrarouge.
Le Plantar test Pour rats et souris est le fruit de l’amélioration de trois générations d’instruments. Conçu en étroite collaboration avec le professeur Ken Hargreaves, il dispose des meilleures fonctionnalités et a fait l’objet de centaines de citations méthode attestant de sa robustesse.
- Opérateur indépendant
- Emet dans l’infra-rouge
- Vérifiable ( radiamètre)
- Rat et souris
- Des centaines de citations
-Viser la surface plantaire avec la source de chaleur IR et appuyer sur le bouton déclencheur !- … la latence de retrait de la patte et l’intensité infrarouge correspondante sont les deux paramètres enregistrés automatiquement (c.-à-d. pas de relevé manuel, comme avec d’autres modèles disponibles sur le marché !).
Ugo Basile a mis au point et commercialisé le Plantar test, il est automatisé depuis l’origine !
Le test plantaire représente une avancée remarquable dans la méthodologie des tests aiguë de douleur, car il combine les meilleures caractéristiques de toutes les autres méthodes de mesure de la sensibilité à la douleur thermique. La principale caractéristique spécifique au test plantaireest que l’animal n’est pas contraint durant les mesures. Contrairement à d’autres modèles proposés, la latence du temps de retrait est enregistrée automatiquement dans la mémoire de l’instrument par un capteur à fibre optique sans avoir à se concentrer sur l’observation expérimentale de l’animal pour arrêter un chronomètre. On évite ainsi un biais expérimental indésirable.
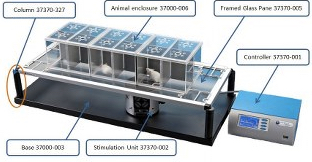
Le Plantar test Hargreaves se compose d’une source de lumière Infrarouge déportée de l’unité principale et placée sous une vitre sur laquelle l’opérateur dépose ses animaux (rats, souris), voir photo. Une enceinte en Perspex définit l’espace dans lequel l’animal peut circuler. Il est divisé en trois compartiments, ce qui aide l’opérateur à effectuer un travail de criblage rapide : jusqu’à 12 animaux peuvent être testés en une même session.
Particularité de notre modèle, la source de chaleur est émise dans l’Infra-Rouge, longueur d’onde qui est invisible de l’animal. Ce qui évite une anticipation de la réponse comme observé avec d’autre modèles.
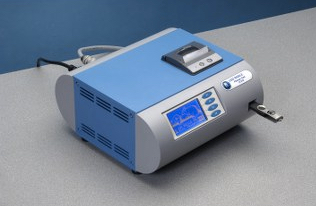
Un circuit de rétroaction par fibre optique détecte les faux réflexes positifs. Les données apparaissent sur l’interface graphique et peuvent être exportées vers une clé USB ou vers l’ordinateur via une connexion câble USB.
L’interface permet de personnaliser ses listes de sujets et affecter la mesure à un groupe prédéfini.
La clé USB de transfert est livré avec l’instrument.
Dans une configuration BPL, les données peuvent être imprimées sur l’imprimante statistique en option, ou sur une mini-imprimante.
Stimulation orofaciale possible avec l’utilisation des boites de contention DURHAM 37100, contactez-nous pour plus d’informations