Description
L’ischémie cérébrale correspond à une interruption du flux sanguin causée par l’obstruction ou la rupture d’une artère cérébrale. Elle est la première cause de handicap et la 2 ème cause de démence et de mortalité en France. Entre 80% et 85% des AVCs humains sont la conséquence de l’occlusion d’une artère cérébrale par un thrombus (caillot sanguin). Cette atteinte neurologique à un impact lourd sur les survivants. En effet, elle génère des déficits fonctionnels subsistant pendant des mois, voire des années. L’utilisation de mono-filaments s’inscrit dans la perspective de développement de nouveaux traitements pour une récupération fonctionnelle de ces déficits. Ils permettant de mimer divers AVC sous leur forme transitoire sur différentes souches de rongeurs.
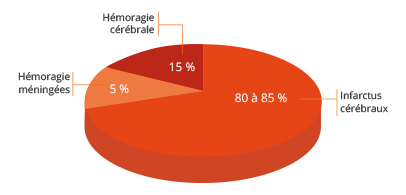
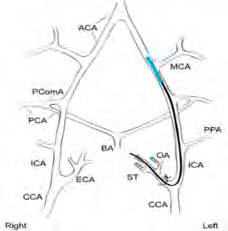
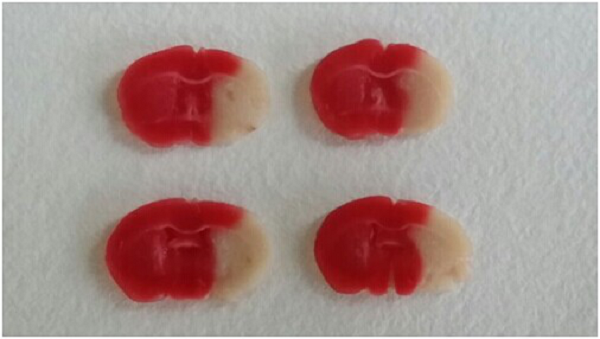
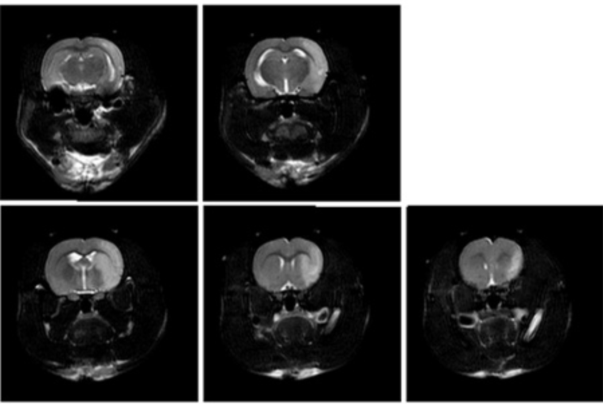
Le modèle murin MCAO (occlusion de l’artère cérébrale moyenne) est la technique la plus utilisée dans le cadre de recherche sur l’ischémie cérébrale type occlusion/re-perfusion. La suture d’occlusion est une méthode courante pour établir le modèle MCAO et en tant que telles, les sutures MCAO sont des dispositifs essentiels pour la génération du traumatisme sur des rats, des souris ou autres sujets. Nos filaments utilisent un mono-filament de nylon qui, en tant que matière première, fait preuve d’une excellente flexibilité pendant la procédure. La tête du filament est uniformément recouverte de silicone. La surface lisse et l’épaisseur est uniforme. Il en résulte une excellente insertion dans le cerveau sans rompre la vésicule; augmentant ainsi considérablement le taux de réussite et de répétabilité. Après modélisation, on pratique généralement un examen comportemental, une imagerie doppler, un test par coloration pour évaluer et analyser la pertinence du modèle généré.
Technique:
L’occlusion proximale de MCAO via la suture intraluminale est ce qu’on appelle le modèle du filament (ou de la suture de l’artère cérébrale moyenne) . Un filament revêtu de silicone est introduit dans l’artère carotide commune et poussé le long de l’artère carotide interne dans le polygone de Willis, d’où il obstrue de départ de l’artère cérébrale moyenne. Par conséquent, les sutures MCAO sont la matière première pour une modélisation réussie des accidents vasculaires cérébraux chez le rat, la souris et d’autres animaux.
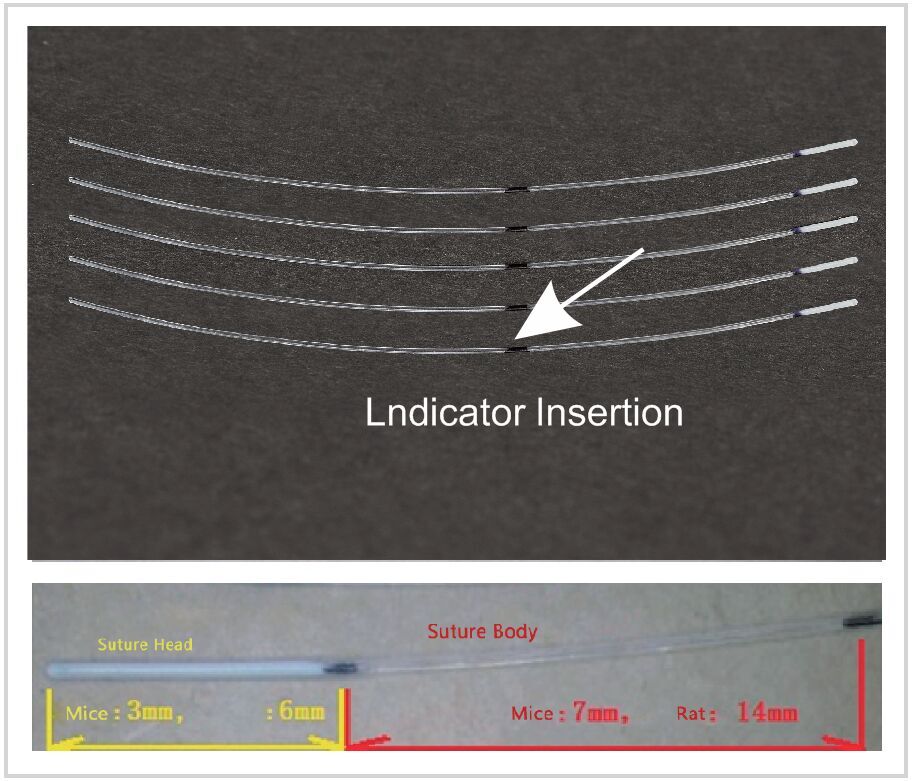
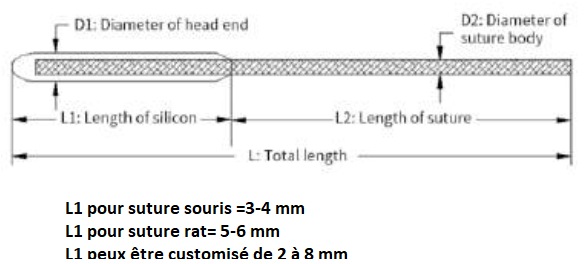
La suture RWD MCAO utilise des mono-filaments recouverts de caoutchouc siliconé de haute qualité. La variation intra-groupe peut être réduite au maximum par leur surface super lisse et la régularité de la suture RWD. Sans rompre la vésicule, la suture RWD fait son insertion dans le cortex beaucoup plus facilement. Les diamètres des pièces revêtues de caoutchouc siliconé varient de 0,21 mm à 0,50 mm; Longueur de suture de 3-5 cm. pour des animaux de poids compris entre 19 et 400 grammes
Notes:
1) Le silicone souple recouvre l’extrémité et en élargit l’épaisseur sans augmenter la rigidité. Ceci permet que le vaisseau sanguin soit complètement obstrué et assure le succès de la génération de l’occlusion.
2) Une suggestion pour les chercheurs les moins expérimentés. Insérer la suture jusqu’à ce que le point d’occlusion soit proche de la bifurcation de l’artère carotide externe et de l’artère carotide.
3) Stérilisés sous ultra-violets et prêt à l’emploi.
4) personnalisé en fonction de vos demandes spécifiques ! contactez nous
Pour commander:
| N° | Référence | Revêtement (l en mm) |
Diamètre extrémité D1 (mm) | Diamètre corps cathéter D2 (mm) | Longueur totale (mm) | Plage de poids (g) | Conditionnement | Espèce |
| 1 | VI-MSMC19B100PK50 | 3-4 mm |
0.17-0.19 | 0.10 | 30 | 15-20 | 50 | souris |
| 2 | VI-MSMC19B007PK50 |
3-4 mm |
0.17-0.19 |
0.07 |
30 |
15-20 |
50 |
souris |
| 3 | VI-MSMC19B008PK50 | 3-4 mm | 0.17-0.19 | 0.08 | 30 | 15-20 | 50 | souris |
| 4 | VI-MSMC21B007PK50 |
3-4 mm | 0.20-0.21 | 0.07 | 30 | 21-25 | 50 | souris |
| 5 | VI-MSMC21B008PK50 | 3-4 mm | 0.20-0.21 | 0.08 | 30 | 21-25 | 50 | souris |
| 6 | VI-MSMC21B100PK50 | 3-4 mm | 0.20-0.21 | 0.1 | 30 | 21-25 | 50 | souris |
| 7 | VI-MSMC21B120PK50 | 3-4 mm | 0.20-0.21 | 0.12 | 30 | 21-25 | 50 | souris |
| 8 | VI-MSMC23B007PK50 |
3-4 mm | 0.22-0.23 | 0.07 | 30 | 26-30 | 50 | souris |
| 9 | VI-MSMC23B008PK50 |
3-4 mm |
0.22-0.23 |
0.08 |
30 |
26-30 |
50 |
souris |
| 10 | VI-MSMC23B100PK50 | 3-4 mm |
0.22-0.23 | 0.1 | 30 | 26-30 | 50 | souris |
| 11 | VI-MSMC23B120PK50 | 3-4 mm |
0.22-0.23 | 0.12 | 30 | 26-30 | 50 | souris |
| 12 | VI-MSMC25B120PK50 | 3-4 mm |
0.24-0.25 | 0.12 | 30 | 31-35 | 50 | souris |
| 13 | VI-MSMC25B150PK50 | 3-4 mm |
0.24-0.25 | 0.15 |
30 | 31-35 | 50 | souris |
| 14 | VI-MSMC26B150PK50 | 3-4 mm |
0.25-0.26 | 0.15 | 30 | sup.35 | 50 | souris |
| 15 | VI-MSRC32B200PK50 | 5-6mm |
0.31-0.32 | 0.20 | 50 | inf.200 | 50 | Rats |
| 16 | VI-MSRC35B200PK50 | 5-6 mm |
0.33-0.35 | 0.20 | 50 | 200-250 | 50 | Rats |
| 17 | VI-MSRC37B200PK50 | 5-6 mm |
0.36-0.37 | 0.20 | 50 | 251-280 | 50 | Rats |
| 18 | VI-MSRC40B200PK50 |
5-6 mm |
0.38-0.40 |
0.20 |
50 |
281-330 |
50 |
Rats |
| 19 | VI-MSRC42B200PK50 | 5-6 mm |
0.41-0.42 | 0.20 |
50 |
331-400 |
50 |
Rats |
| 20 | VI-MSRC45B200PK50 |
5-6 mm |
0.43~0.45 | 0.20 |
50 |
sup.400 |
50 |
Rats |